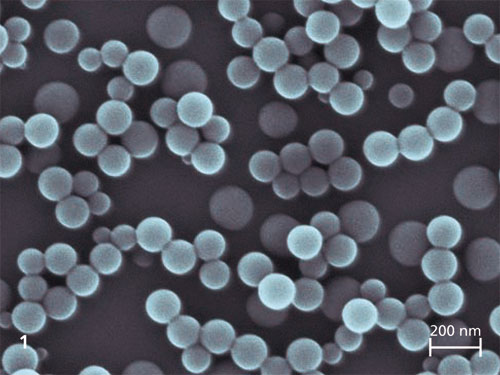
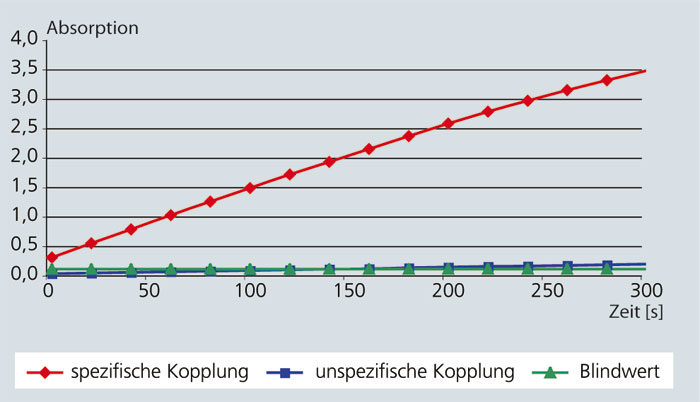
Enzyme sind vielseitige Biokatalysatoren, die zunehmend Einsatz in industriellen Bereichen finden. Allerdings ist die technische Anwendung eines Enzyms oft durch eine mangelhafte Langzeitstabilität unter realen Verfahrensbedingungen und durch Schwierigkeiten beim Recycling eingeschränkt. Diese Schwachstellen können durch eine Immobilisierung der Enzyme umgangen werden. Zudem bietet die Immobilisierung die Möglichkeit, sowohl die katalytischen Eigenschaften zu verbessern als auch Proteinkontaminationen im Produkt zu vermeiden.
Vorteile für den Verbraucher
Motivation für die Verwendung intelligenter Verpackungsmaterialien ist, die Sicherheit für den Verbraucher zu erhöhen. Mithilfe der Verpackungen können Verbraucher zukünftig unmittelbar während des Einkaufs die Haltbarkeit sowie die Qualität der angebotenen Lebensmittel kontrollieren.
 Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB
Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB