Indikationen und Markt
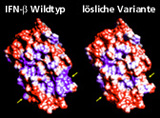
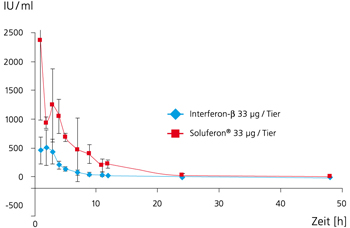
Interferon-β besitzt mit der Indikation Multiple Sklerose einen wachsenden Markt von über drei Milliarden US$. Die Hydrophobizität des humanen Interferon- β ist sowohl unter technischen als auch unter pharmazeutischen Aspekten unerwünscht. Die daraus resultierende starke Aggregationsneigung erzwingt einen hohen technischen Aufwand bei der Reindarstellung des Proteins. Dies wirkt sich negativ auf die Ausbeute, die Formulierung, die Stabilität und die Bioverfügbarkeit aus. Eine am Fraunhofer IGB gentechnisch erzeugte Interferon-β-Variante mit 9 ausgetauschten Aminosäuren ist besser löslich (Bild 1) und besitzt eine höhere Bioverfügbarkeit (Bild 3). Folgende Aminosäuren wurden gegen Serin ausgetauscht: Leu5, Phe8, Cys17, Leu47, Phe50, Leu106, Phe111, Leu116, und Leu120.
 Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB
Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB