Interferone sind Proteine und Bestandteil unseres Immunsystems. Sie werden nur bei Bedarf (Induktion) in spezialisierten Zellen synthetisiert, aus diesen ausgeschieden und binden dann an hochspezifische Rezeptoren auf ihren Zielzellen. Diese hochspezifische Wechselwirkung mit dem Rezeptor löst eine Signaltransduktion aus, durch die die Information in den Kern der Zielzelle gelangt und dort bis zu 50 verschiedene Gene reguliert.
Interferone als Therapeutika: Proteindesign mit Interferonen
Wirkung der Interferone
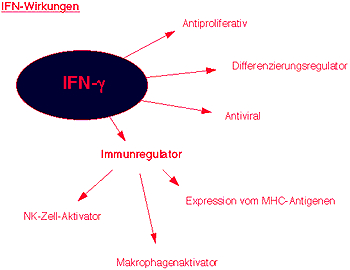
Interferone wirken über die Rezeptorbindung pleiotrop, d.h. sie vermitteln biologische Aktivitäten wie
- antiviral, antiinfektiös
- antiproliferativ, cytotoxisch
- immunmodulierend
Alle diese Aktivitäten versprechen einen hohen pharmazeutischen Wert, der teilweise bei viralen und onkologischen Indikationen eingelöst werde konnte.
Klassen der Interferone
Es gibt drei Klassen von Interferonen, 16 Subgruppen des Interferon-alpha, ein Interferon-beta und ein Interferon-gamma. Die Interferone sind verhältnismäßig kleine Proteine mit 143 bis 172 Aminosäuren und Molekulargewichten von 19.000 bis 45.000 dalton. Die Interferone sind durch Glykosylierung modifiziert. Das IFN-gamma ist als ein homodimeres Protein organisiert; alle anderen Interferone liegen in einer monomeren Organisationsform vor.
Klinisches und Marktpotential der Interferone
Alle Interferone werden gentechnisch hergestellt; bevorzugtes Synthesesystem sind Bakterienzellen. IFN-alpha-2 wird, neben onkologischen Indikationen, bei der Hepatitisinfektion verwendet. Der jährliche Umsatz des IFN-alpha-2 übersteigt 1 Milliarde Dollar. Ein ähnlicher Umsatz wird in den nächsten Jahren für das IFN-beta erwartet, das bei Multipler Sklerose hilft. Ein umsatzmäßiges Mauerblümchendasein fristet das IFN-gamma, das bei chronischer Granulomatose, Nierenkrebs und Rheuma eingesetzt wird.
Beispiel: IFN-gamma
IFN-gamma ist als ein homodimeres Protein mit je 143 Aminosäurenkettenlänge organisiert. An zwei Asparaginen ist es glykosyliert. Die dreidimensionale Struktur ist mittlerweile beschrieben worden. Das IFN-gamma ist weniger antiviral als die Typ I Interferone, besitzt jedoch eine sehr viel stärkere antiproliferative und immunmodulierende Aktivität. Das IFN-gamma wird in Bakterienzellen produziert, obwohl hier nur ein nichtglykosyliertes IFN synthetisiert werden kann. Soweit untersucht, beeinflusst die Glykosylierung aber die biologischen Aktivitäten des IFN-gamma nicht. Nichtglykosyliert ist das IFN-gamma ein sehr stark basisches Protein mit einem IP von mehr als 10. Im Vergleich zu den Typ I Interferonen ist es weniger pH-stabil und zeigt mit einem Schmelzpunkt von 52 °C eine sehr viel geringere Thermostabilität als die anderen Interferone. Eingesetzt wird ein mit dem natürlichen IFN-gamma in der Aminosäurensequenz identisches IFN.
Aus den oben genannten Gründen haben verschiedene Gruppen wie auch unsere versucht, durch Veränderung des Proteins auf DNA-Ebene ein IFN-gamma mit erhöhter Stabilität bzw. erhöhter biologischer Aktivität zu gewinnen. Dieses neue »Second Generation« IFN-gamma-HA wurde patentiert.
Die Bekanntgabe der Struktur des IFN-gamma erlaubte dann durch eine Kombination von Proteinmodelling und gentechnischen Arbeiten – also einer Kombination von Informatik und Molekularbiologie - ein sehr viel gezielteres Design. Durch das gezielte Einbringen einer Disulfidbrücke konnte das IFN-gamma fester geschnürt und eine Variante hergestellt werden, die einen um 18 °C (TM 70 °C) erhöhten Schmelzpunkt zeigt. Dieses neue IFN-gamma-HS mit erhöhter Temperaturstabilität ist in allen Aspekten charakterisiert und zum Patent angemeldet worden und wird zur weiteren pharmazeutischen Entwicklung angeboten.
 Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB
Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB