Therapeutische Proteine gewinnen stetig höhere Anteile am Pharmamarkt. Monoklonale Antikörper beispielsweise zeigen Wachstumsraten im zweistelligen Bereich und auch länger bekannte Proteine wie Interferon-β (IFN-β) liegen weltweit bei einem Jahresumsatz von drei Milliarden US Dollar. Die Behandlung mit IFN-β ist eine der aktuellen Basistherapien für die häufigste Form der multiplen Sklerose (MS), der »relapsing-remitting« MS. Die Kosten für IFN-β belaufen sich in Deutschland auf 18 000 Euro pro Patient und Jahr mit der Konsequenz, dass die meisten der weltweit 2,5 Millionen MS-Patienten nicht adäquat mit IFN-β behandelt werden können. Dabei sind die für eine Behandlung erforderlichen Wirkstoffmengen mit 45 mg pro Patient und Jahr für IFN-β-1b sehr gering.
Extraktions- und Reinigungsverfahren für Interferon-beta-1b
Zwei Formen von IFN-beta
Aktuell sind zwei Formen von IFN-β auf dem Markt. Die rekombinant in tierischen Zellen hergestellte Form (IFN-β-1a) entspricht in der Aminosäuresequenz und Glycosylierung der humanen Form. Die handelsübliche rekombinante in E. coli exprimierte Variante dagegen ist nicht glycosyliert und unterscheidet sich von der natürlichen humanen Form am N-Terminus (Methionin wird abgespalten) und an der Position 17 durch Austausch von Cystein gegen Serin. Die in E. coli hergestellte Form wird als IFN-β-1b bezeichnet. Der Patentschutz beider Formen läuft aus. Dadurch ergibt sich die Möglichkeit, IFN-β als Biosimilar einem breiteren Patientenkreis preisgünstiger und in weiten Teilen der Welt überhaupt erst verfügbar zu machen.
Kriterien für ein optimiertes Herstellungsverfahren
Ziel eines aktuellen Projekts am Fraunhofer IGB ist die Entwicklung eines Verfahrens zur Herstellung von IFN-β-1b im industriellen Maßstab. Dabei sind der Preis, die Sicherheit der Produkte, die Stabilität der Prozesse (Robustheit) und die Skalierbarkeit von zentraler Bedeutung. Eine hohe Expressionsrate, geringe Kosten für Medien und Fermentation sowie einfache und stabile Verfahren zur Isolierung und Reinigung (downstream processing) entscheiden über den wirtschaftlichen Erfolg und über eine sichere Patientenversorgung.
Klonierung und Expression
Wissenschaftler am Fraunhofer IGB konnten einen hochproduzierenden Klon, welcher eine an E. coli angepasste IFN-β-1b-Gensequenz trägt, etablieren. Dieser erlaubt eine Expression des gewünschten IFN-β-1b-Proteins innerhalb der Zellen als Einschlusskörperchen (inclusion bodies). Durch eine Hochzelldichtefermentation wurde mit diesem Klon eine stabile und hohe Expressionsrate von mindestens 20 Prozent IFN-β-1b des Gesamtzellproteins erreicht.
Skalierbarer Aufarbeitungsprozess

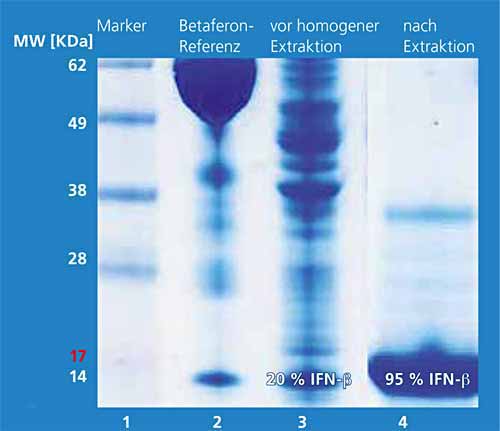
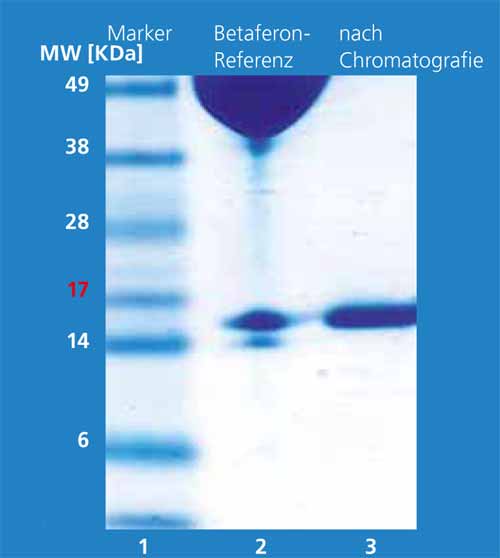
Die Isolierung, Reinigung und Solubilisierung der IFN-β-Proteine aus »Inclusion Bodies« ist bisher ein technisch aufwendiger Prozess. Ziel war es, einen technisch einfachen und skalierbaren Aufarbeitungsprozess für IFN-β-1b auszuarbeiten. Hierfür werden die Bakterienzellen unmittelbar nach der Fermentation mit einem kombinierten enzymatisch/mechanischen Verfahren aufgeschlossen. Aus diesem Zellhomogenat wird das Zielprotein mit hoher Ausbeute und Selektivität in nur einem Extraktionsschritt mit 2-Butanol gewonnen. Das hydrophobe Interferon-β wandert mit Hilfe von grenzflächenaktiven Substanzen in die obere organische Phase (2-Butanol). Bakterielle Proteine finden sich nach der Phasentrennung aufkonzentriert als Feststoff zwischen der unteren wässrigen und der oberen organischen Phase. Die untere wässrige Phase enthält die hydrophilen Inhaltstoffe der Zellen wie Salze und DNA/RNA. Bild 1 zeigt die drei Phasen nach einer durch Zentrifugation erzwungenen Phasentrennung. Bild 2 zeigt die Proteinmuster mittels SDS-PAGE vor dem Extraktionsschritt (Spur 3) und in der organischen Phase (Spur 4). Das Zielprotein liegt vor dem Extraktionsschritt mit einem Anteil um 20 Prozent vor, nach der Extraktion hat es eine Reinheit von 95 Prozent. Nachfolgende chromatographische Schritte erhöhen die Reinheit weiter (Bild 3).
Ausblick
Mit dem am Fraunhofer IGB etablierten, technisch einfachen und skalierbaren Aufarbeitungsprozess für IFN-β-1b wird der größte Teil der bakteriellen Proteine direkt in einer ersten Reinigungsstufe abgetrennt. Die aufwendige Isolierung, Reinigung und Solubilisierung der Inclusion Bodies, die mit hohen Verlusten einhergehen, können wir damit vermeiden. Der Prozess liefert ein IFN-β-1b hoher Reinheit, das kostengünstig im industriellen Maßstab hergestellt werden kann.
Projektpartner
- CinnaGen Inc., Teheran, Iran
 Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB
Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB