Eiweiße nach Wunsch für die Industrie zusammenbauen – das ist das Ziel des Fraunhofer-Verbundprojekts »Biomoleküle von Band«, das Mitte März 2011 als erste konkrete Maßnahme im Strategieprozess Biotechnologie 2020+ des Bundesministeriums für Bildung und Forschung (BMBF) gestartet ist.
Zellfreie Bioproduktion mit integrierter Energieversorgung
- Fraunhofer-Verbundprojekt »Biomoleküle von Band« (zellfreie-bioproduktion.fraunhofer.de)
Produktion biotechnologisch relevanter Proteine
Die Verfügbarkeit hochwertiger funktionaler Biomoleküle ist wesentliche Grundlage der Fortschrittsfähigkeit unserer entwickelten modernen Gesellschaft. So steigt der Bedarf an Enzymen, ebenso wie der an komplexen Peptiden, Pharmaproteinen und synthetischen Biomolekülen für Medizin und Pharmazie. Derzeitig werden peptidbasierte Substanzen und deren Produktionsverfahren hauptsächlich mithilfe lebender Zellen oder Organismen entwickelt. Diese Technologie ist zwar inzwischen sehr leistungsfähig, erfährt aber auf vielen Ebenen deutliche Einschränkungen. So limitiert beispielsweise der beträchtliche Stoff- und Energieeintrag die Wirtschaftlichkeit, viele Endprodukte wirken toxisch auf die produzierenden Zellen oder Organismen, und Schritte zur Reinigung der Zielproteine und Abtrennung sämtlicher zellulären Bestandteile der Organismen sind oft sehr schwierig und aufwendig.
Zellfreie Proteinsynthese im industriellen Maßstab
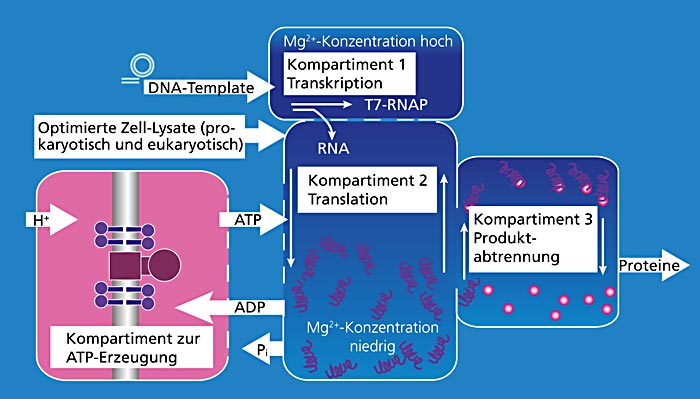
Hier eröffnet die zellfreie Proteinsynthese neue Möglichkeiten. Durch den spezifischen Einsatz der nur hierfür notwendigen Komponenten ist es möglich, in adaptierten Reaktionskompartimenten effizient Proteine mit definierten Funktionen herzustellen. Obwohl sehr intensiv an der zellfreien Biosynthese geforscht wird, fehlen derzeit noch viele Grundlagen, um diese Technologie wirtschaftlich sinnvoll nutzen zu können.
Daher etablieren acht Fraunhofer-Institute innerhalb des 2011 im Rahmen des Strategieprozesses Biotechnologie 2020+ des BMBF gestarteten Fraunhofer-Verbundprojekts »Biomoleküle vom Band« diejenigen Elemente, die den Ausbau der Technologie in industrielle Maßstäbe ermöglichen sollen. Dazu soll die Technologie der zellfreien Proteinsynthese auf leistungsfähige, kompartimentierte Reaktorsysteme übertragen werden.
Energiebereitstellung als limitierender Faktor
Hierbei ist die Produktion und Bereitstellung von Energie für das System in Form von ATP (Adenosintriphosphat) von essenzieller Bedeutung. ATP ist die universelle, hauptsächliche Energieform für alle energieabhängigen zellulären Prozesse und daher ebenso wichtig für die zellfreie Biosynthese. In der Zelle ist für die Regeneration von ATP hauptsächlich der hochkomplexe, protonengetriebene Proteinkomplex ATP-Synthase verantwortlich. Das Fraunhofer IGB befasst sich unter anderem damit, die ATP-Synthase in geeigneter Anordnung als Energieregenerationsmodul für die zellfreie Proteinsynthese zu nutzen und so neue Maßstäbe in der zellfreien Bioproduktion zu setzen.
Vorgehensweise
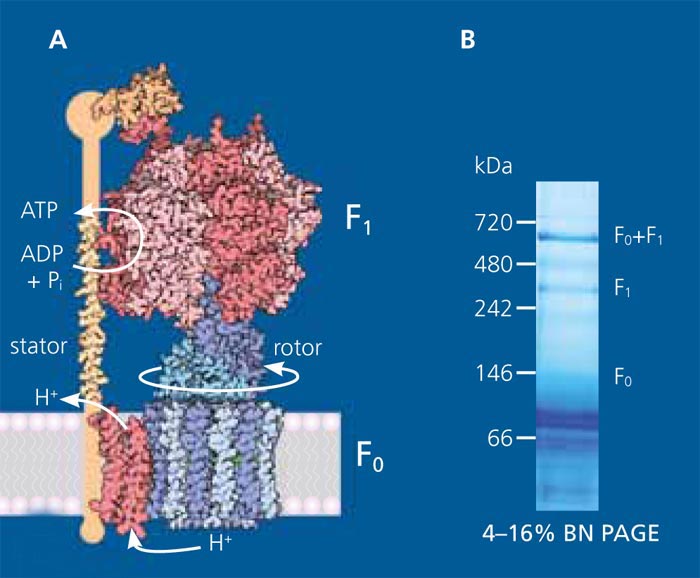
Am Fraunhofer IGB wird die ATP-Synthase, ein membranständiger Proteinkomplex bestehend aus acht Untereinheiten, in E. coli hergestellt und aufgereinigt. Die ATP-Synthase wird anschließend gerichtet und biologisch aktiv in Lipidmembranen (Vesikel und planare Membranen) rekonstituiert. Um die ATP-Synthese zu gewährleisten, muss die Membran durch einen Protonengradienten energetisiert werden. Hierzu wird das Protein Bacteriorhodopsin (BR) aus dem salztoleranten Archaebakterium Halobacterium salinarum verwendet, welches mittels Licht einen Protonengradienten generieren kann. Durch Ko-Rekonstitution von ATP-Synthase und Bacteriorhodopsin in Lipidvesikel kann durch die Bestrahlung dieser Vesikel mit Licht ATP für die zellfreie Biosynthese regeneriert werden.
Komponenten in Reinform hergestellt
Am Fraunhofer IGB wurden alle Komponenten für ein Energieregenerationsmodul in Reinform hergestellt:
- In einem ersten Ansatz wurde die hochkomplexe ATP-Synthase
funktional in invertierten E.-coli-Vesikeln isoliert. Mit diesem System konnten wir bereits erfolgreich ATP synthetisieren. - Zum anderen haben wir die ATP-Synthase mittels eines His-Tags über Affinitätschromatographie gereinigt [2]. Dies ermöglicht eine definierte und konzentrierte Integration der ATP-Synthase in Lipidvesikel.
- Lipidvesikel mit einem Durchmesser von 50 nm bis 10 μm wurden durch Membranextrusion oder Elektroformation hergestellt.
- Bacteriorhodopsin konnten wir durch osmotische Lyse und selektive Zentrifugation aus Halobacterium salinarum gewinnen.
Die Herstellung dieser Komponenten in Reinform ermöglicht es nun, Bedingungen für eine optimale, stabile ATP-Synthese zu etablieren.
Ausblick
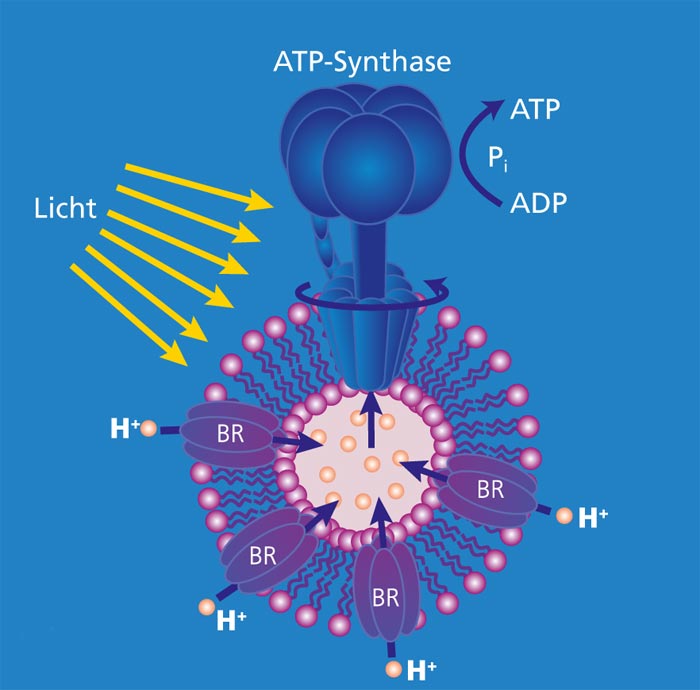
Die ATP-Synthase und das Bacteriorhodopsin sollen gerichtet in Lipidvesikeln oder planaren Lipidmembranen korekonstituiert werden. Hierzu sollen geeignete Bedingungen gefunden werden, um über einen angemessenen Zeitraum kontinuierlich ATP regenerieren zu können. Dieses Energieregenerationsmodul wird anschließend in ein Kompartiment des zellfreien Biosynthese-Reaktors integriert.
Literatur
[1] Weber, J. (2006) ATP synthase: subunit-subunit interactions in the stator stalk, Biochim Biophys Acta 1757(9-10): 1162-1170
[2] Ishmukhametov, R. R.; Galkin, M. A. et al. (2005) Ultrafast purification and reconstitution of His-tagged cysteine-less Escherichia coli F1F0 ATP synthase, Biochim Biophys Acta 1706(1-2): 110-116
[3] Choi, H. J. and Montemagno C. D. (2005) Artificial organelle: ATP synthesis from cellular mimetic polymersomes, Nano Lett 5(12): 2538-2542
Förderung
Wir danken dem Bundesministerium für Bildung und Forschung (BMBF) für die Förderung des Verbundprojekts »Biomoleküle vom Band« im Rahmen des Programms Biotechnologie 2020+ und der Fraunhofer-Gesellschaft für die Förderung des Verbundprojekts »Basismodul für die zellfreie Bioproduktion – Die Industriezelle« im Rahmen der Fraunhofer-Systemforschung.
Projektpartner
- Fraunhofer IBMT, Berlin
- Fraunhofer ISIT, Itzehoe
- Fraunhofer IZM, Berlin
- Fraunhofer IPA, Stuttgart
- Fraunhofer IPK, Berlin
- Fraunhofer IME, Aachen
- Fraunhofer ISI, Karlsruhe
Weitere Informationen
- zur Homepage der Systemforschungzur Homepage der Systemforschung (zellfreie-bioproduktion.fraunhofer.de)
Referenzprojekt
Fraunhofer-Leitprojekt »Zellfreie Bioproduktion«
Laufzeit: März 2011 – August 2014
Enzyme, komplexen Peptide und Pharmaproteine für Medizin und Pharmazie werden hauptsächlich mithilfe lebender Zellen oder Organismen entwickelt. Diese Technologie ist zwar inzwischen sehr leistungsfähig, erfährt aber auf vielen Ebenen deutliche Einschränkungen. So limitiert beispielsweise der beträchtliche Stoff- und Energieeintrag die Wirtschaftlichkeit, viele Endprodukte wirken toxisch auf die produzierenden Zellen, und Schritte zur Reinigung der Zielproteine sind oft sehr aufwendig. Im Leitprojekt soll daher untersucht werden, wie sich Proteine in zellfreien Systemen herstellen lassen.
 Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB
Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB